新型冠状病毒肺炎与呼吸系统损害的研究现状、今后的临床及转化研究问题讨论
发布时间 2021-12-10 阅读 2865

2019年末新型冠状病毒肺炎(COVID-19)爆发,新冠病毒作为一种新型病原体引发人体产生重症急症呼吸综合征。新冠病毒肺炎重症患者最常出现的临床表现,即与急性呼吸窘迫综合征类似的急性呼吸衰竭。新冠病毒肺炎患者可见呼吸道、肺实质、肺血管和呼吸系统神经肌肉的病变。
下面,基于目前国内外的研究,简述相关研究结果以及未来的研究方向及成果转化。
01
临床实践、放射学及病理学方面
在临床实践中,出现低氧血症的新冠肺炎患者往往存在呼吸困难、心悸等症状,然而低氧血症与患者自觉的呼吸困难却不成比例。Gattinoni等的研究显示,生理上的分流(肺非通气呼吸单元的灌注)可能伴随通气/血流(V/Q)严重异常,而在这其中缺氧性肺血管收缩障碍发挥着关键作用。
研究人员还注意到低氧血症的严重程度与患者呼吸系统顺应性间的差异,表明了V/Q严重异常是发生急性呼吸窘迫综合征的新冠肺炎患者的显著特征。
在放射学方面,新冠肺炎患者可能见到正常的肺实质、磨玻璃密度影、局灶性实变以及肺血管灌注异常。将新冠肺炎患者的CT与其他类型病毒性肺炎患者的CT进行比较,可见新冠肺炎患者间质样的改变、磨玻璃影、浸润影血管增厚更加明显。
病理学研究让我们对于感染新冠肺炎病毒后所导致的人体的损害有了更加深入的洞见。新冠肺炎患者尸检结果显示肺充血,呈斑片状分布异常。
镜检结果包括弥漫性肺泡损伤(DAD)伴透明膜形成、肺细胞活化、微血管血栓、淋巴细胞炎症和蛋白性水肿。
少量尸检报告结果显示,新冠肺炎早期死亡病例可见肺泡腔内蛋白和纤维素渗出、炎症细胞大量的浸润,而在病程晚期的死亡病例中多见肺间质纤维化表现为网格影或索条影。
02
肺泡上皮和间质方面
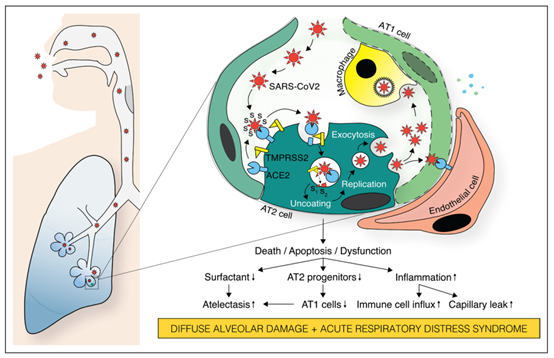
图1:由新冠病毒感染引发的急性呼吸系统综合征引起肺泡上皮损伤的病理生物学结果
虽然新冠病毒的感染通常始于呼吸道上皮,但在部分患者中病毒扩散感染损伤肺泡上皮,导致气体交换明显受损及呼吸衰竭(如图1)。
03
血管内皮细胞方面
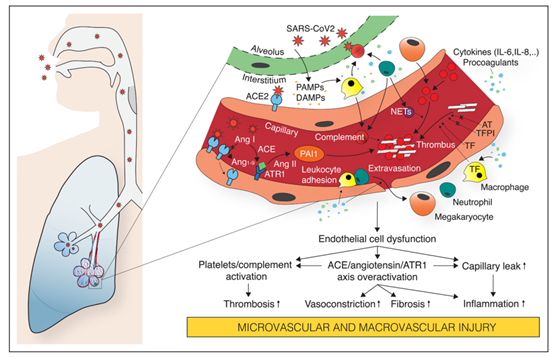
图2:由新冠病毒感染引发的急性呼吸系统综合征引起血管内皮损伤的病理生物学结果
内皮细胞是新冠病毒感染的重要“目标”,血管内皮细胞功能紊乱(障碍)可能导致感染。肺血管内皮与血管平滑肌协同作用,通过逆转一氧化氮通路等调节因子,实现缺氧血管收缩,使灌注与空间通气相匹配;调节凝血;调节白细胞进入间质,这一过程主要发生在毛细血管水平;它是水、溶质和较大分子在等离子体和间隙间扩散的屏障。
基于以上重要功能,内皮细胞功能障碍或缺失可能导致新冠肺炎患者产生严重的肺损伤(如图2)。
04
静脉血栓栓塞性疾病与肺微血管血栓形成方面
相关的研究发现新冠肺炎患者中存在血栓形成和炎症反应过程的相互作用,且可通过新冠病毒感染特有的机制引起高凝状态。已发表的报道显示,新冠肺炎患者可出现血小板计数变化和凝血指标异常,且可能与预后有关。
钟南山团队的报道显示,中国新冠肺炎患者中D-二聚体升高及血小板下降的占比分别高达 46.4% 和 36.2%,且这种异常在危重患者中更为显著。新冠病毒感染除了引发肺血管的功能障碍导致炎症性血栓形成,还可以造成机体整体的高凝状态导致大血管和微血管血栓。对静脉血栓栓塞性疾病高风险的患者,有必要通过预防性抗凝治疗来预防疾病的发生。
目前越来越多的研究正在聚焦新冠肺炎相关血栓性疾病的病理生理学机制,这些研究有望深入解析静脉血栓栓塞性疾病和肺微血栓发生的机制,从而为科学的临床干预策略提供指导。
05
研究展望
新冠病毒仍在全球范围内流行和传播。对于新冠病毒的基础研究仍在探索和攻坚阶段,防控指南的更新说明我们对于病毒的认识不断加深,对于这一疾病已有一定的研究成果。然而,在病毒的突变情况和传播,疾病的发病机制,治疗疾病的特效药物等方面仍面临诸多挑战。