Patritumab Deruxtecan在两项早期试验的最新结果显示在治疗多种转移性肺癌和乳腺癌患者方面具有积极的临床活性
发布时间 2023-03-29 阅读 2273
点击蓝字 关注我们
# I期试验的最新结果,包括来自在一次JSMO主席会议上汇报的EGFR突变型转移性非小细胞肺癌患者队列的首次数据报告
# HER2表达的亚组分析(来自在第二次主席会议上强调的表达HER3的转移性乳腺癌患者的1/2期试验)
东京和巴斯金里奇,NJ-(2023年3月20日)——第一三共旗下(TSE:4568)patritumab deruxtecan(HER3-DXd)的两项早期试验[这两项试验是关于先前接受过治疗的EGFR突变型转移性非小细胞肺癌(NSCLC)(#PS1-2)或表达HER3的转移性乳腺癌(#PS2-4)患者]的最新数据在日本医学肿瘤学会(#JSMO2023)年会上进行了两次主席会议汇报。
Patritumab deruxtecan是基于第一三共独创的DXd ADC技术平台由第一三共独立研发的一种潜在同类首创HER3靶向抗体偶联药物(ADC)。
肺癌和乳腺癌是全球癌症相关死亡的第一和第五大主要原因,2020年分别导致约180万人和68.5万人死亡。1,2 需要新的治疗方法来改善肺癌和乳腺癌的预后。由于HER3在肺癌和乳腺癌中广泛表达,它是治疗发展的一个有前景的靶点。3,4,5
参与这两项早期试验的大多数肺癌或乳腺癌患者均已接受了多线治疗,这表明亟需创新的治疗方案来帮助患者改善预后。这些结果提供的证据进一步表明,HER3靶向抗体偶联药物patritumab deruxtecan可能是多种转移性肺癌和乳腺癌患者亚型的一种潜在的治疗选择。
EGFR突变型NSCLC I期试验结果
Patritumab deruxtecanI期试验汇总分析的最新数据(包括已接受多线治疗的EGFR突变型局部晚期或转移性NSCLC患者(队列3a)结果的首次汇报)表明,在为期23个月的中位随访时间(范围,11.8-36.0)后显示出积极的临床疗效。这些数据在2023年3月16日的主席会议上汇报。
在102例EGFR突变型NSCLC患者的汇总分析中,经盲态独立中心审查(BICR)评估patritumab deruxtecan的客观缓解率(ORR)为40.2%(95% C:30.6-50.4)。其中有1例完全缓解(CR),40例部分缓解(PR),39例病情稳定(SD)。疾病控制率(DCR)为78.4%(95% CI:69.2-86.0),中位缓解持续时间(DOR)为7.6个月(95% CI:6.9-14.7)。中位无进展生存期(mPFS)为6.4个月(95% CI:5.3-8.3),中位总生存期(mOS)为15.8个月(95% CI:10.8-21.5)。先前接受第三代EGFR TKI和含铂化疗的78例患者的疗效结果一致。
Patritumab deruxtecan在HER3广泛表达和多种EGFR TKI耐药机制的患者中均有缓解效果。此外,在有和没有中枢神经系统(CNS)转移史的患者中ORR分别为36.4%(95% CI: 23.8-50.4)和44.7%(95% CI: 33.2 -59.9)。
Patritumab deruxtecan的中位总生存期超过15个月,在这些接受过多线治疗的局部晚期或转移性EGFR突变型非小细胞肺癌患者中尤其令人惊叹。patritumab deruxtecan在EGFR突变型NSCLC患者中的疗效有待进一步评估。
局部晚期/转移性患者接受过的中位全身治疗次数为4次(范围1-14),中位持续治疗时间为5.5个月(范围0.7-27.5)。在这项I期试验中观察到的patritumab deruxtecan的安全性与先前在EGFR突变型NSCLC患者中观察到的安全性一致。58例患者(56.9%)发生3级以上的治疗期间不良事件(TEAE),包括血小板计数下降(26%)、中性粒细胞计数下降(21%)、疲劳(10%)、贫血(9%)、白细胞计数下降(8%)、恶心(7%)、低钾血症(%)、淋巴细胞计数下降(7%)、呼吸困难(6%)和发热性中性粒细胞减少(6%)。8例患者(7.8%)经独立评审委员会确诊为治疗相关间质性肺疾病(ILD)。这些ILD事件大多级别较低,其中2例为1级,3例为2级,1例为3级,2例为5级。截至2022年1月28日的数据显示,8例患者仍在接受patritumab deruxtecan的研究治疗。
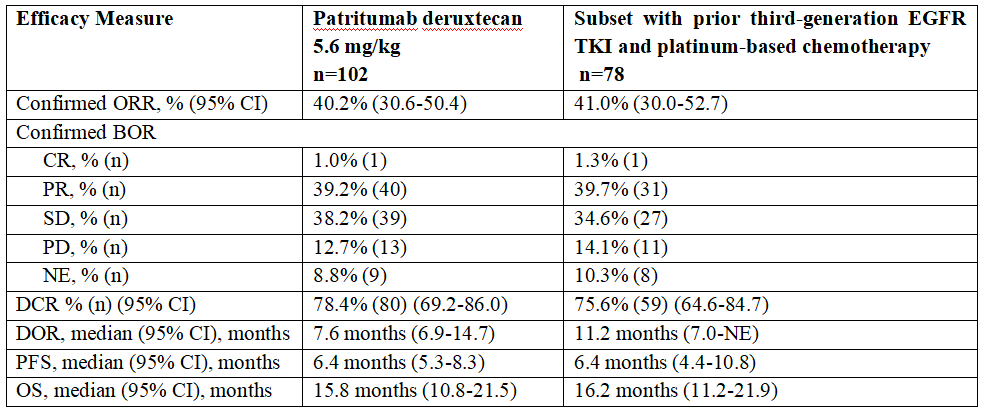
BOR, best overall response; CR, complete response; DCR, disease control rate; DOR, duration of response; NE, not evaluable; ORR, objective response rate; OS, overall survival; PD, progressive disease; PFS, progression-free survival; PR, partial response; SD, stable disease.
表达HER3的转移性乳腺癌1/2期
试验中HER2表达的亚组分析
最新公布的HER2表达的探索性亚组分析(HER2低定义为IHC 1+或IHC2+/ISH-;一项由三部分组成的、首次在人体内进行的1/2期试验(n=182)评估了patritumab deruxtecan在已接受过多线治疗的表达HER3的转移性乳腺癌(包括HR阳性/HER2阴性和三阴性乳腺癌(TNBC)患者中的临床活性,显示出有具有前景的临床活性。这些数据是在2023年3月17日的第二次主席会议中报告。
在HR阳性的乳腺癌患者中,HER2低表达患者(n=58)的经确认ORR为36.2%(95%,CI:24.0-49.9),HER2零表达患者(n=39)为28.2% (95% CI:15.0-44.9)。HER2低表达亚组和HER2零表达亚组的中位DOR分别为7.2个月( 95% CI:5.5-NE)和7.0个月(95% CI:3.0-NE),中位PFS分别为5.8个月(95% CI:4.1-8.5)和8.2个月(95% CI:5.8-9.1),中位OS分别为13.7个月(95% CI:8.5-20.1)和14.6个月(95% CI:11.0-21.0)。
在TNBC患者中,HER2低表达患者(n=29)的经确认ORR为20.7%(95% CI:8.0-39.7), HER2零表达患者(n=19)为26.3%(95% CI:9.1-51.2)。HER2低表达亚组和HER2零表达亚组的中位DOR分别为4.1个月(95% CI:2.7-6.0)和8.4个月(95% CI:4.2-NE),中位PFS分别为4.4个月(95% CI:2.6-5.6)和8.4个月(95% CI:3.9-13.9),OS分别为12.7个月(95% CI:9.2-21.8)和16.6个月(95% CI:9.3-23.8)。
先前报告的patritumab deruxtecan的汇总安全性按照不同剂量(4.8 mg/kg和6.4 mg/kg)和患者地域差异(日本[n=142]或美国[n=40])进行进一步分析,日本和美国亚组之间的TEAE总体发生率相似(不包括ILD)。日本有99例(69.7%)≥3级的TEAE,美国有21例(52.5%)。经独立裁判委员会鉴定,日本12例(8.5%)和美国0例确诊为治疗相关性ILD。大多数ILD事件为低级别,其中有3例1级(2.1%),5例2级(3.5%),3例3级(2.1%)和1例5级(0.7%)。
这些数据扩展了之前的观察结果,并证明patritumab deruxtecan在转移性乳腺癌和HER2低表达或HER2零表达患者中显示出临床活性。这些数据支持进一步对patritumab deruxtecan作为乳腺癌的潜在治疗方案进行评价,并更多地了解关于其他疗法的合适测序方法。
各个亚组的患者均接受了过度预治疗,HR阳性的HER2低表达和HER2零表达亚组接受了中位7线既往全身治疗线,HR阴性HER2低表达亚组接受了中位4线既往全身治疗线,HR阴性HER2零表达亚组接受了3线既往全身治疗线。HR阳性HER2低表达亚组的中位治疗时间为5.5个月(范围0.7-28.4),HR阳性HER2零表达亚组的中位治疗时间为7.6个月(范围1.4-22.8),HR阴